Page 67 - chemia_k8
P. 67
Reakcja tlenku metalu z kwasem
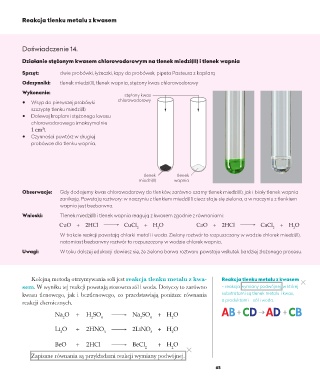
Doświadczenie 14.
Działanie stężonym kwasem chlorowodorowym na tlenek miedzi(II) i tlenek wapnia
Sprzęt: dwie probówki, łyżeczki, łapy do probówek, pipeta Pasteura z kapilarą
Odczynniki: tlenek miedzi(II), tlenek wapnia, stężony kwas chlorowodorowy
Wykonanie:
stężony kwas
• Wsyp do pierwszej probówki chlorowodorowy
szczyptę tlenku miedzi(II).
• Dolewaj kroplami stężonego kwasu
chlorowodorowego (maksymalnie
3
1 cm ).
• Czynności powtórz w drugiej
probówce dla tlenku wapnia.
tlenek tlenek
miedzi(II) wapnia
Obserwacje: Gdy dodajemy kwas chlorowodorowy do tlenków, zarówno czarny tlenek miedzi(II), jak i biały tlenek wapnia
zanikają. Powstają roztwory: w naczyniu z tlenkiem miedzi(II) ciecz staje się zielona, a w naczyniu z tlenkiem
wapnia jest bezbarwna.
Wnioski: Tlenek miedzi(II) i tlenek wapnia reagują z kwasem zgodnie z równaniami:
CuO + 2HCl CuCl + H O CaO + 2HCl CaCl + H O
2 2 2 2
W trakcie reakcji powstają chlorki metali i woda. Zielony roztwór to rozpuszczony w wodzie chlorek miedzi(II),
natomiast bezbarwny roztwór to rozpuszczony w wodzie chlorek wapnia.
Uwagi: W toku dalszej edukacji dowiesz się, że zielona barwa roztworu powstaje wskutek bardziej złożonego procesu.
Kolejną metodą otrzymywania soli jest reakcja tlenku metalu z kwa- Reakcja tlenku metalu z kwasem
sem. W wyniku tej reakcji powstają stosowna sól i woda. Dotyczy to zarówno – reakcja wymiany podwójnej, w której
kwasu tlenowego, jak i beztlenowego, co przedstawiają poniższe równania substratami są tlenek metalu i kwas,
reakcji chemicznych. a produktami − sól i woda.
+
+
—>
Na O + H SO 4 Na SO + H O AB CD AD CB
2
2
4
2
2
Li O + 2HNO 3 2LiNO + H O
3
2
2
BeO + 2HCl BeCl + H O
2
2
Zapisane równania są przykładami reakcji wymiany podwójnej.
65
10.06.2021 11:48:19
0610_881399_chemia_kl8_podrecznik_DRUK.indd 65 10.06.2021 11:48:19
0610_881399_chemia_kl8_podrecznik_DRUK.indd 65