Page 78 - chemia_k8
P. 78
Jak dane z tabeli rozpuszczalności odnoszą się do praktyki laboratoryjnej
Przeprowadźmy doświadczenie, które sprawdzi, jak tabela rozpuszczalności odnosi się do praktyki laboratoryjnej.
Doświadczenie 17.
Działanie roztworami jednych elektrolitów na drugie
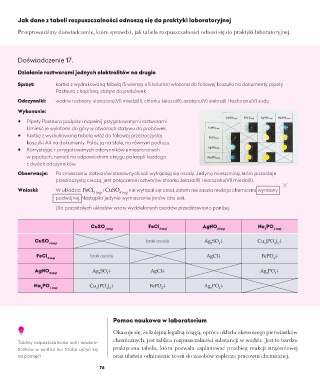
Sprzęt: kartka z wydrukowaną tabelą (5 wierszy x 5 kolumn) włożona do foliowej koszulki na dokumenty, pipety
Pasteura z kapilarą, statyw do probówek
Odczynniki: wodne roztwory: siarczanu(VI) miedzi(II), chlorku żelaza(III), azotanu(V) srebra(I) i fosforanu(V) sodu
Wykonanie:
• Pipety Pasteura podpisz i napełnij przygotowanymi roztworami.
Umieść je wylotami do góry w otworach statywu do probówek.
• Kartkę z wydrukowaną tabelą włóż do foliowej przezroczystej
koszulki A4 na dokumenty. Połóż ją na stole, na równym podłożu.
• Korzystając z przygotowanych odczynników umieszczonych
w pipetach, nanieś na odpowiednim okręgu po kropli każdego
z dwóch odczynników.
Obserwacje: Po zmieszaniu roztworów stosownych soli wytrącają się osady. Jedyną mieszaniną, która pozostaje
przezroczystą cieczą, jest połączenie roztworów chlorku żelaza(III) i siarczanu(VI) miedzi(II).
Wnioski: W układzie: FeCl 3 (aq) i CuSO 4 (aq) nie wytrącił się osad, zatem nie zaszła reakcja chemiczna wymiany
podwójnej. Nastąpiło jedynie wymieszanie jonów obu soli.
Dla pozostałych układów wzory wydzielonych osadów przedstawiono poniżej.
CuSO FeCl AgNO Na PO
4 (aq) 3 (aq) 3 (aq) 3 4 (aq)
CuSO brak osadu Ag SO ↓ Cu (PO ) ↓
4 (aq) 2 4 3 4 2
FeCl brak osadu AgCl ↓ FePO ↓
3 (aq) 4
AgNO Ag SO ↓ AgCl ↓ Ag PO ↓
3 (aq) 2 4 3 4
Na PO Cu (PO ) ↓ FePO ↓ Ag PO ↓
3 4 (aq) 3 4 2 4 3 4
Pomoc naukowa w laboratorium
Okazuje się, że kolejną legalną ściągą, oprócz układu okresowego pierwiastków
chemicznych, jest tablica rozpuszczalności substancji w wodzie. Jest to bardzo
Tablicy rozpuszczalności soli i wodoro-
tlenków w wodzie nie trzeba uczyć się praktyczna tabela, która pozwala zaplanować przebieg reakcji strąceniowej
na pamięć! oraz ułatwia odniesienie teorii do zasobów zaplecza pracowni chemicznej.
76
10.06.2021 11:48:26
0610_881399_chemia_kl8_podrecznik_DRUK.indd 76 10.06.2021 11:48:26
0610_881399_chemia_kl8_podrecznik_DRUK.indd 76