Page 109 - 883351_podrecznik chemia_kl7_nowaPP
P. 109
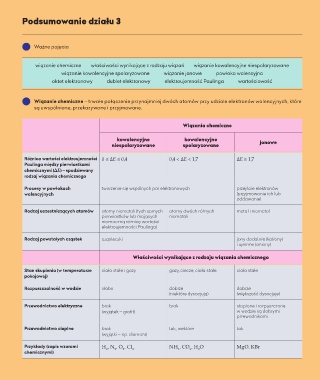
Podsumowanie działu 3
Ważne pojęcia
wiązanie chemiczne właściwości wynikające z rodzaju wiązań wiązanie kowalencyjne niespolaryzowane
wiązanie kowalencyjne spolaryzowane wiązanie jonowe powłoka walencyjna
oktet elektronowy dublet elektronowy elektroujemność Paulinga wartościowość
Wiązanie chemiczne – trwałe połączenie przynajmniej dwóch atomów przy udziale elektronów walencyjnych, które
są uwspólniane, przekazywane i przyjmowane.
Wiązania chemiczne
kowalencyjne kowalencyjne jonowe
niespolaryzowane spolaryzowane
Różnica wartości elektroujemności 0 ≤ ∆E ≤ 0,4 0,4 < ∆E < 1,7 ∆E ≥ 1,7
Paulinga między pierwiastkami
chemicznymi (∆E) – spodziewany
rodzaj wiązania chemicznego
Procesy w powłokach tworzenie się wspólnych par elektronowych przejście elektronów
walencyjnych (przyjmowanie ich lub
oddawanie)
Rodzaj uczestniczących atomów atomy niemetali (tych samych atomy dwóch różnych metal i niemetal
pierwiastków lub mających niemetali
nieznaczną różnicę wartości
elektroujemności Paulinga)
Rodzaj powstałych cząstek cząsteczki jony dodatnie (kationy)
i ujemne (aniony)
Właściwości wynikające z rodzaju wiązania chemicznego
Stan skupienia (w temperaturze ciała stałe i gazy gazy, ciecze, ciała stałe ciała stałe
pokojowej)
Rozpuszczalność w wodzie słabo dobrze dobrze
(niektóre dysocjują) (większość dysocjuje)
Przewodnictwo elektryczne brak brak stopione i rozpuszczone
(wyjątek – grafit) w wodzie są dobrymi
przewodnikami
Przewodnictwo cieplne brak tak, niektóre tak
(wyjątki – np. diament)
Przykłady (zapis wzorami H , N , O , Cl NH , CO , H O MgO, KBr
chemicznymi) 2 2 2 2 3 2 2
107