Page 156 - 883351_podrecznik chemia_kl7_nowaPP
P. 156
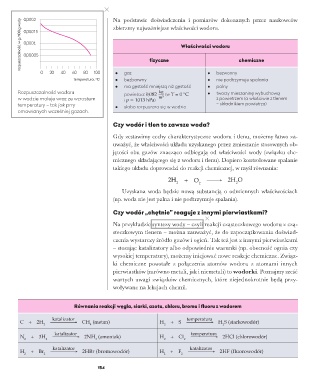
rozpuszczalność, w g / 100 g wody 0,0002 Na podstawie doświadczenia i pomiarów dokonanych przez naukowców
zbierzmy najważniejsze właściwości wodoru.
0,00015
0,0001
Właściwości wodoru
0,00005
0 20 40 60 80 100 • gaz fizyczne • bezwonny chemiczne
temperatura, C • bezbarwny • nie podtrzymuje spalania
o
• ma gęstość mniejszą niż gęstość • palny
Rozpuszczalność wodoru powietrza: 0,082 kg (w T = 0 °C • tworzy mieszaninę wybuchową
w wodzie maleje wraz ze wzrostem i p = 1013 hPa) m 3 z powietrzem (a właściwie z tlenem
temperatury – tak jak przy • słabo rozpuszcza się w wodzie − składnikiem powietrza)
omawianych wcześniej gazach.
Czy wodór i tlen to zawsze woda?
Gdy zestawimy cechy charakterystyczne wodoru i tlenu, możemy łatwo za-
uważyć, że właściwości układu uzyskanego przez zmieszanie stosownych ob-
jętości obu gazów znacząco odbiegają od właściwości wody (związku che-
micznego składającego się z wodoru i tlenu). Dopiero kontrolowane spalanie
takiego układu doprowadzi do reakcji chemicznej, w myśl równania:
2H + O 2H O
2
2
2
Uzyskana woda będzie nową substancją o odmiennych właściwościach
(np. woda nie jest palna i nie podtrzymuje spalania).
Czy wodór „chętnie” reaguje z innymi pierwiastkami?
Na przykładzie syntezy wody – czyli reakcji cząsteczkowego wodoru z czą-
steczkowym tlenem – można zauważyć, że do zapoczątkowania doświad-
czenia wystarczy źródło gazów i ogień. Tak też jest z innymi pierwiastkami
– stosując katalizatory albo odpowiednie warunki (np. obecność ognia czy
wysokiej temperatury), możemy inicjować nowe reakcje chemiczne. Związ-
ki chemiczne powstałe z połączenia atomów wodoru z atomami innych
pierwiastków (zarówno metali, jak i niemetali) to wodorki. Poznajmy sześć
wartych uwagi związków chemicznych, które niejednokrotnie będą przy-
woływane na lekcjach chemii.
Równania reakcji węgla, siarki, azotu, chloru, bromu i fluoru z wodorem
C + 2H katalizator CH (metan) H + S temperatura H S (siarkowodór)
2
4
2
2
N + 3H katalizator 2NH (amoniak) H + Cl temperatura 2HCl (chlorowodór)
2 2 3 2 2
H + Br katalizator 2HBr (bromowodór) H + F katalizator 2HF (fluorowodór)
2
2
2
2
154