Page 75 - 883351_podrecznik chemia_kl7_nowaPP
P. 75
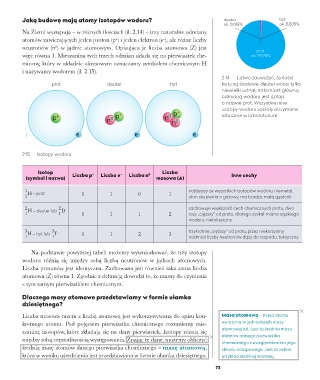
Jaką budowę mają atomy izotopów wodoru? deuter tryt
ok. 0,015% ok. 0,005%
Na Ziemi występują – w różnych ilościach (il. 2.14) – trzy naturalne odmiany
atomów zawierających jeden proton (p ) i jeden elektron (e ), ale różne liczby
+
–
neutronów (n ) w jądrze atomowym. Opisująca je liczba atomowa (Z) jest prot
0
więc równa 1. Mieszanina tych trzech odmian składa się na pierwiastek che- ok. 99,98%
miczny, który w układzie okresowym oznaczamy symbolem chemicznym H
i nazywamy wodorem (il. 2.15).
2.14 Łatwo zauważyć, że ilości
prot deuter tryt trytu są śladowe, deuter wnosi tylko
niewielki udział, natomiast główną
odmianą wodoru jest izotop
o nazwie prot. Wszystkie inne
izotopy wodoru zostały otrzymane
sztucznie w laboratorium
2.15 Izotopy wodoru
Izotop Liczba
+
0
Liczba p Liczba e − Liczba n Inne cechy
(symbol i nazwa) masowa (A)
1 najlżejszy ze wszystkich izotopów wodoru, niemetal,
1 H – prot 1 1 0 1 stan skupienia – gazowy, ma bardzo małą gęstość
2
2 H – deuter lub D zachowuje większość cech chemicznych protu, dwa
1 1 1 1 1 2 razy „cięższy” od protu, dlatego zyskał miano ciężkiego
wodoru, nietoksyczny
3 3 trzykrotnie „cięższy” od protu, przez niekorzystny
1 H – tryt lub T 1 1 2 3 nadmiar liczby neutronów dąży do rozpadu, toksyczny
1
Na podstawie powyższej tabeli możemy wywnioskować, że trzy izotopy
wodoru różnią się między sobą liczbą neutronów w jądrach atomowych.
Liczba protonów jest identyczna. Zachowana jest również taka sama liczba
atomowa (Z) równa 1. Zgodnie z definicją dowodzi to, że mamy do czynienia
z tym samym pierwiastkiem chemicznym.
Dlaczego masy atomowe przedstawiamy w formie ułamka
dziesiętnego?
Liczba masowa razem z liczbą atomową jest wykorzystywana do opisu kon- Masa atomowa − masa atomu
kretnego atomu. Pod pojęciem pierwiastka chemicznego rozumiemy mie- wyrażona w jednostkach masy
szaninę izotopów, które składają się na dany pierwiastek. Izotopy różnią się atomowej (u). Jest to średnia masa
atomów danego pierwiastka
między sobą częstotliwością występowania. Znając te dane, możemy obliczyć chemicznego z uwzględnieniem jego
średnią masę atomów danego pierwiastka chemicznego – masę atomową, składu izotopowego. Jest to zatem
która w wyniku uśrednienia jest przedstawiana w formie ułamka dziesiętnego. przykład średniej ważonej.
73