Page 129 - 883351_podrecznik chemia_kl7_nowaPP
P. 129
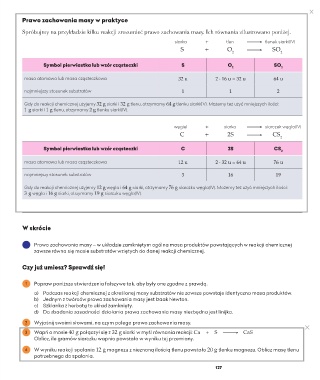
Prawo zachowania masy w praktyce
Spróbujmy na przykładzie kilku reakcji zrozumieć prawo zachowania masy. Ich równania zilustrowano poniżej.
siarka + tlen tlenek siarki(IV)
S + O SO 2
2
Symbol pierwiastka lub wzór cząsteczki S O SO
2 2
masa atomowa lub masa cząsteczkowa 32 u 2 ∙ 16 u = 32 u 64 u
najmniejszy stosunek substratów 1 1 2
Gdy do reakcji chemicznej użyjemy 32 g siarki i 32 g tlenu, otrzymamy 64 g tlenku siarki(IV). Możemy też użyć mniejszych ilości:
1 g siarki i 1 g tlenu, otrzymamy 2 g tlenku siarki(IV).
węgiel + siarka siarczek węgla(IV)
C + 2S CS
2
Symbol pierwiastka lub wzór cząsteczki C 2S CS
2
masa atomowa lub masa cząsteczkowa 12 u 2 ∙ 32 u = 64 u 76 u
najmniejszy stosunek substratów 3 16 19
Gdy do reakcji chemicznej użyjemy 12 g węgla i 64 g siarki, otrzymamy 76 g siarczku węgla(IV). Możemy też użyć mniejszych ilości:
3 g węgla i 16 g siarki, otrzymamy 19 g siarczku węgla(IV).
W skrócie
Prawo zachowania masy – w układzie zamkniętym ogólna masa produktów powstających w reakcji chemicznej
zawsze równa się masie substratów wziętych do danej reakcji chemicznej.
Czy już umiesz? Sprawdź się!
1 Popraw poniższe stwierdzenia fałszywe tak, aby były one zgodne z prawdą.
a) Podczas reakcji chemicznej z określonej masy substratów nie zawsze powstaje identyczna masa produktów.
b) Jednym z twórców prawa zachowania masy jest Izaak Newton.
c) Szklanka z herbatą to układ zamknięty.
d) Do zbadania zasadności działania prawa zachowania masy niezbędna jest linijka.
2 Wyjaśnij swoimi słowami, na czym polega prawo zachowania masy.
3 Wapń o masie 40 g połączył się z 32 g siarki w myśl równania reakcji: Ca + S CaS
Oblicz, ile gramów siarczku wapnia powstało w wyniku tej przemiany.
4 W wyniku reakcji spalania 12 g magnezu z nieznaną ilością tlenu powstało 20 g tlenku magnezu. Oblicz masę tlenu
potrzebnego do spalania.
127