Page 193 - chemia_k8
P. 193
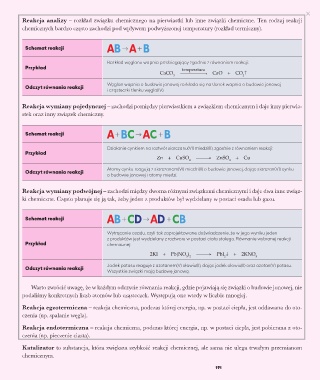
Reakcja analizy – rozkład związku chemicznego na pierwiastki lub inne związki chemiczne. Ten rodzaj reakcji
chemicznych bardzo często zachodzi pod wpływem podwyższonej temperatury (rozkład termiczny).
AB A B
+
—>
Schemat reakcji
Rozkład węglanu wapnia przebiegający zgodnie z równaniem reakcji:
Przykład temperatura
CaCO 3 CaO + CO ↑
2
Węglan wapnia o budowie jonowej rozkłada się na tlenek wapnia o budowie jonowej
Odczyt równania reakcji
i cząsteczki tlenku węgla(IV).
Reakcja wymiany pojedynczej – zachodzi pomiędzy pierwiastkiem a związkiem chemicznym i daje inny pierwia-
stek oraz inny związek chemiczny.
A BC AC B
—>
+
+
Schemat reakcji
Działanie cynkiem na roztwór siarczanu(VI) miedzi(II), zgodnie z równaniem reakcji:
Przykład
Zn + CuSO 4 ZnSO 4 + Cu
Atomy cynku reagują z siarczanem(VI) miedzi(II) o budowie jonowej, dając siarczan(VI) cynku
Odczyt równania reakcji
o budowie jonowej i atomy miedzi.
Reakcja wymiany podwójnej – zachodzi między dwoma różnymi związkami chemicznymi i daje dwa inne związ-
ki chemiczne. Często planuje się ją tak, żeby jeden z produktów był wydzielany w postaci osadu lub gazu.
AB CD AD CB
+
+
—>
Schemat reakcji
Wytrącanie osadu, czyli tak zaprojektowane doświadczenie, że w jego wyniku jeden
z produktów jest wydzielany z roztworu w postaci ciała stałego. Równanie wybranej reakcji
Przykład chemicznej:
2KI + Pb(NO ) PbI ↓ + 2KNO 3
2
3 2
Jodek potasu reaguje z azotanem(V) ołowiu(II), dając jodek ołowiu(II) oraz azotan(V) potasu.
Odczyt równania reakcji
Wszystkie związki mają budowę jonową.
Warto zwrócić uwagę, że w każdym odczycie równania reakcji, gdzie pojawiają się związki o budowie jonowej, nie
podaliśmy konkretnych liczb atomów lub cząsteczek. Występują one wtedy w liczbie mnogiej.
Reakcja egzotermiczna – reakcja chemiczna, podczas której energia, np. w postaci ciepła, jest oddawana do oto-
czenia (np. spalanie węgla).
Reakcja endotermiczna – reakcja chemiczna, podczas której energia, np. w postaci ciepła, jest pobierana z oto-
czenia (np. pieczenie ciasta).
Katalizator to substancja, która zwiększa szybkość reakcji chemicznej, ale sama nie ulega trwałym przemianom
chemicznym.
191
10.06.2021 11:52:37
0610_881399_chemia_kl8_podrecznik_DRUK.indd 191
0610_881399_chemia_kl8_podrecznik_DRUK.indd 191 10.06.2021 11:52:37